科技
联系我们
中国科学院动物研究所金万洙团队发现饮食诱导产热的关键蛋白并揭示其作用机制
肥胖是一种慢性疾病,可导致多种疾病的发生,如糖尿病、心血管疾病、非酒精性脂肪肝、肿瘤等,严重影响患者的健康和生活质量。随着经济发展和久坐等不良生活方式的扩散,肥胖的患病率呈快速增长。至2020年,我国成年居民的超重和肥胖人数已经超过50%,总人数位居世界第一,肥胖已成为我国亟待解决的公共健康问题。长期能量摄入超过能量消耗造成脂肪累积是肥胖发生的根本原因,因此,减少能量摄入或促进能量消耗是防治肥胖的策略。然而,迄今为止,临床应用的减肥药物多通过抑制食欲而实现减重,因作用于中枢可产生诸多不良反应,难以满足临床减重需求。促进能量消耗是实现减重的另一理想策略,但目前临床尚无相关药物,因此一直是代谢领域内的研究热点。
饮食减肥法是目前常用的减肥模式,比如卡路里限制饮食(Caloric restriction, CR),近几年更为流行的是间歇性轻断食(Intermittent fasting, IF),该方法根据禁食时间,可分为每天限制时间饮食、1:1饮食(进食一天、饥饿一天)、5:2饮食(进食5天、饥饿2天)等。近期的研究发现,间歇性轻断食能提高能量消耗、改善肥胖;临床研究也证实该方法能降低肥胖人群的体重。因此全面解析IF抑制肥胖的分子机制对新减肥药物的开发具有重要指示作用。机体各器官间的相互作用对维持机体代谢平衡至关重要,而器官之间的相互作用是否在间歇性轻断食的减重作用中发挥作用尚不清楚。
2021年9月,中国科学院动物研究所金万洙研究员团队在Advanced Science杂志上发表文章Hepatokine pregnancy zone protein governs the diet-induced thermogenesis through activating brown adipose tissue (DIO:10.1002/advs.20211991),该研究通过对饮食诱导的肝脏分泌蛋白的筛选鉴定并验证了妊娠区带蛋白(Pregnancy zone protein, PZP)有助于小鼠抵抗高脂饮食引起的肥胖。
PZP是肝脏特异性高分泌蛋白,属于α2M 家族蛋白。既往研究发现在妊娠、老年痴呆等状态下,该蛋白丰度波动较大,而其生理功能尚不清楚。金万洙团队发现,在小鼠和人体内,肥胖个体的血清以及肝脏PZP蛋白水平低于正常体重的个体;而进食状态下,小鼠和人体的血清和肝脏中PZP蛋白增加,提示PZP蛋白可能参与进食后机体代谢的调控。
金万洙团队通过PZP蛋白的功能缺失实验发现,在正常高脂饮食条件下,PZP缺失不影响小鼠体重;而在高脂饲料联合间歇性轻断食的条件下,PZP缺失导致小鼠体重显著增加。 有趣的是,PZP缺失小鼠并没有吃的更多或运动减少,但其进食后的体温和能耗降低,这提示PZP对体重的调控与抑制食欲、减少运动无关,而与促进能量消耗相关。而作为肝脏的分泌蛋白,PZP促进能量消耗的分子机制是什么呢?
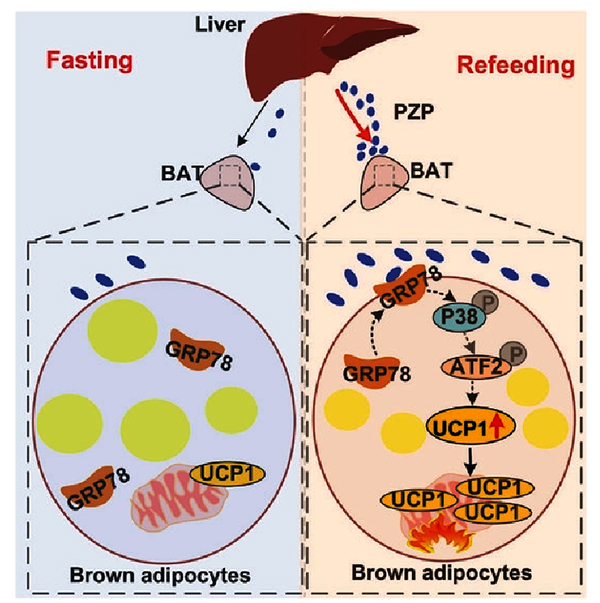
棕色脂肪是具有产热、耗能作用的特殊脂肪组织,该组织的UCP1蛋白可将物质分解产生的高能质子运输进入线粒体基质,进而解偶联电子传递与ATP合成的能量转换路径,使得化学能以热能的形式释放出去。金万洙团队的进一步研究发现,PZP缺失小鼠体内的UCP1蛋白丰度显著降低,因而其棕色脂肪耗能降低,导致体重增加。该结果表明肝脏分泌的PZP蛋白可激活BAT产热,在间歇性轻断食诱导的减重中具有重要作用。
为进一步解析PZP调控能量代谢的分子机制,该团队在细胞里共表达BAT cDNA文库和PZP蛋白,结合免疫共沉淀和蛋白质谱技术,鉴定出BAT中GRP78蛋白是PZP的受体。GRP78蛋白是一个内质网蛋白,金万洙团队发现在IF状态下,BAT中的GRP78蛋白特异性转位到细胞膜,结合来自肝脏分泌的PZP蛋白,从而完成跨器官的信号交流转导,激活BAT中的p38 MAPK-ATF2信号通路促进UCP1的表达,从而增加脂肪组织产热,减轻肥胖并改善相关代谢紊乱。
在间歇性轻断食条件下,给予外源性PZP蛋白可降低野生型小鼠的体重增长,但对UCP1缺失小鼠的体重无影响,说明PZP蛋白对代谢的调控依赖于UCP1蛋白,同时也提示在一定的代谢状态下,补给外源PZP蛋白具有减轻肥胖的作用。更为惊喜的是,给已经肥胖的PZP缺失小鼠注射PZP蛋白可显著减轻其体重,而注射对照蛋白的小鼠即使在IF策略下体重也无变化。这些结果进一步显示PZP蛋白具有减重的作用,也暗示了间歇性断食的饮食方案中,部分人群减重效果不明显的一个可能原因是由于该人群中PZP蛋白表达丰度相对较低。
该研究阐明在饮食诱导下,肝脏分泌的PZP蛋白可与棕色脂肪组织上的GRP78受体相结合,激活p38 MAPK-ATF2-UCP1信号通路而促进棕色脂肪产热,改善肥胖以及相关代谢紊乱,揭示了间歇性饮食条件下肝脏与棕色脂肪之间相互作用的分子机制,为以调控产热为靶点而防治肥胖提供了重要的依据,有望得以实现临床转化,为治疗减重提供新策略。
中国科学院动物研究所金万洙研究员和复旦大学附属华山医院内分泌科张朝云主任医师为本研究的共同通讯作者。中国科学院动物所博士后林骏 (现在为北京大学医学院博士后)和博士生蒋笑笑为该研究的共同第一作者。本项目获得了国家自然科学基金重点项目、科技部重点研发计划以及中国博士后科学基金特别资助的支持,在此一并鸣谢!

文章连接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202101991
来源:中国科学院动物研究所






